510(k) 데이터는 일반적으로 'Summary' 또는 'Statement' 상태로 공개되며, 특히 'Statement' 상태의 제품 정보는 요청을 통해 별도로 열람해야 합니다. 이번 글에서는 510(k) 'Statement' 상태 제품 정보 조회 및 요청 방법에 대해 알아보겠습니다.
▶ 510(k) 데이터 조회
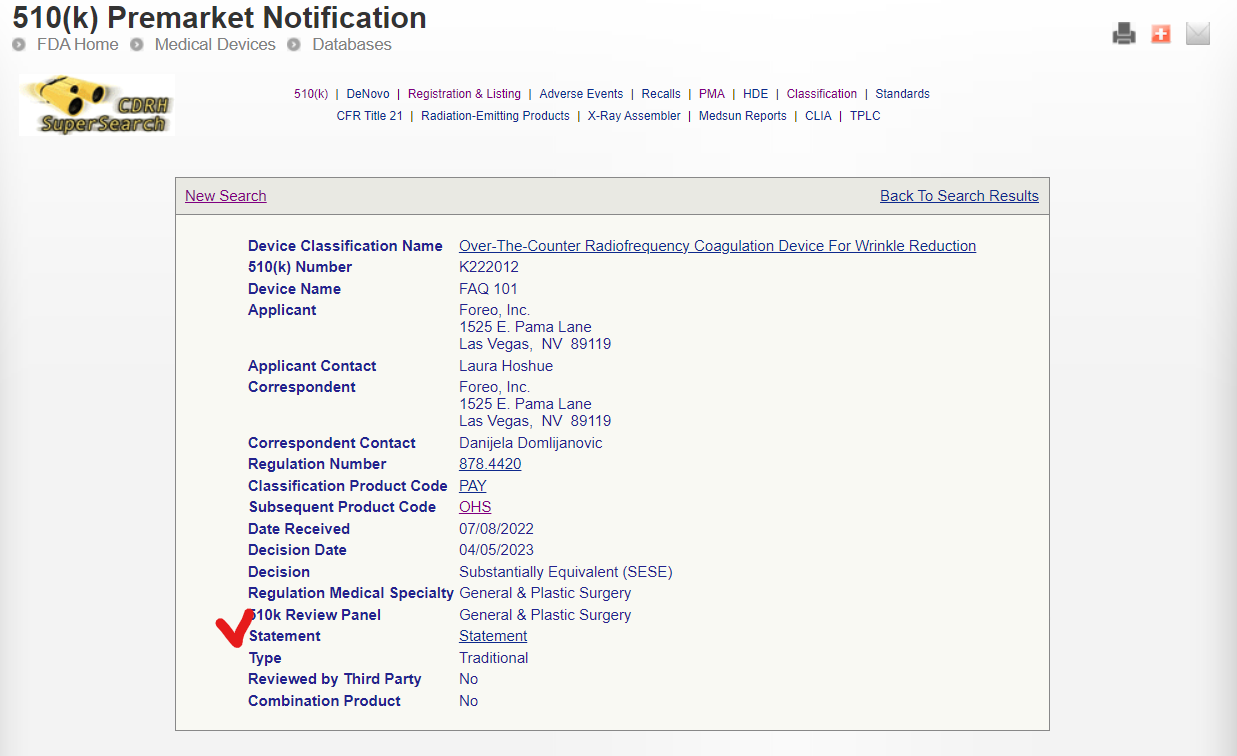
510(k) 데이터는 FDA의 정책에 따라 두 가지 방식으로 공개됩니다.
- Summary 상태: 510(k) 제출 요약 문서가 FDA 홈페이지에 공개되어 누구나 열람할 수 있습니다.
- Statement 상태: 제출자는 510(k) 정보 공개를 제한할 수 있으며, 이 경우 제품 정보는 요청을 통해서만 확인 가능합니다.
'Statement' 상태 제품은 제조사의 기밀 유지 요청에 따라 특정 데이터가 비공개 처리될 수 있으므로 정보 조회 절차가 중요합니다.
▶ 'Statement' 상태 제품 정보 조회
1. 제조사에 연락 시도
510(k) 소유자는 21 CFR 807.93에 따라 요청받은 정보를 제공해야 할 의무가 있습니다.
- 제조사에 재연락: 제조사 또는 공식 연락처(Official Correspondent)를 통해 정보를 요청할 수 있습니다.
- 등록 및 목록 데이터베이스 확인: FDA의 Registration and Listing Database에서 최신 연락처를 확인할 수 있습니다.

2. FDA에 규제 위반 신고
제조사가 응답하지 않거나 요청을 이행하지 않을 경우, 활용하는 강력한 조치입니다.
- FDA의 Allegations of Regulatory Misconduct 프로세스를 활용하여 제조사가 규정을 위반했음을 신고할 수 있습니다.
- 신고 프로세스:
- FDA의 Regulatory Misconduct Website에서 온라인 신고서를 작성합니다.
- 관련 증빙 자료가 있을 경우 제출합니다.
3. 정보공개법(FOIA) 요청 제출
FDA에 Freedom of Information Act(FOIA) 요청을 제출해 정보를 받을 수 있습니다. 제조사의 응답과 상관없이 정보를 얻을 수 있는 독립적인 경로입니다.
- 방법:
- FOIA 요청 방법 페이지를 방문합니다.
- 요청서를 작성해 이메일 또는 우편으로 제출합니다.
- FOIA 요청에는 일정한 수수료가 부과될 수 있으니 FOIA 요금 정보를 확인할 수 있습니다.
510(k) 'Statement' 상태 제품의 정보는 시장 경쟁력이나 기밀 보호 등의 이유로 일반 공개되지 않을 수 있습니다.
하지만 FOIA 요청을 통해 필요한 정보를 확보하면 제품의 승인 상태를 확인하고, 관련 연구나 사업 개발에 활용할 수 있습니다. 정확한 요청서 작성과 적합한 절차 준수를 통해 FDA로부터 원하는 정보를 효과적으로 얻으시길 바랍니다. ^^

'FDA' 카테고리의 다른 글
| 해외 GLP 기관에서 의료기기 생물학적 안전성 시험을 진행하는 장점 (2) | 2025.01.15 |
|---|---|
| FDA 의료기기 공장등록(시설등록)하는 방법 (0) | 2024.12.19 |
| 미국 FDA의 품질경영시스템 규정(QMSR) 도입과 변화 (0) | 2024.12.08 |